De atoomkern – instabiele kern, isotoop en nuclide
Een kernwapen maakt gebruik van energie die ligt opgeslagen in atoomkernen. Bij een ontploffing komt deze energie vrij. Om dit te kunnen begrijpen is enige kennis over atomen en hun kernen nodig, zoals over de begrippen ‘isotoop’ en ‘instabiele kern’.
Atomen zijn de bouwstenen van de natuur. Scheikundig gezien zijn het de kleinste deeltjes waarin je materie kan opdelen.
Natuurkundig gezien bestaan er nog kleinere deeltjes. Er bestaan protonen (p), neutronen (n) en elektronen (e). Deze deeltjes zijn onderdeel van een atoom, maar kunnen ook los voorkomen.
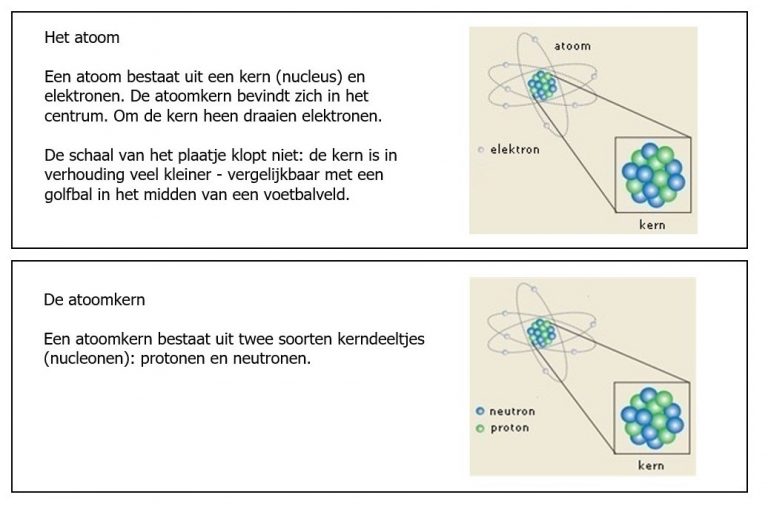
De hoeveelheid protonen in de kern bepaalt de soort stof. Waterstof heeft bijvoorbeeld 1 proton in de kern, helium heeft 2 protonen in de kern, en lood 82.
Een stof met dezelfde atomen wordt een element genoemd. In de natuur komen voornamelijk 92 elementen voor, van waterstof tot en met uranium.
In het periodiek systeem zijn de elementen naar het aantal protonen in de kern gerangschikt.
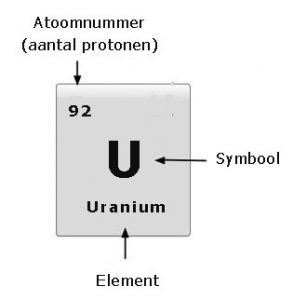
In het atoomtijdperk hebben wetenschappers veel nieuwe atomen gemaakt door het aantal protonen in de kern te vergroten. Zo ontstaan bijvoorbeeld neptunium (93) plutonium (94) en americium (95), de zogenaamde ‘transuranen’. Er zijn indmiddels meer dan 110 elementen bekend. Sommige van deze transuranen komen in de natuur alleen in minieme hoeveelheden voor.
§1 ATOOMMASSA – NUCLIDEN EN ISOTOPEN
Bijna alle massa van een atoom zit in de kern. Een elektron weegt bijna niets in vergelijking met een proton en een neutron. De massa van een proton en neutron zijn gelijkgesteld aan 1 atomaire massa-eenheid (u). De atoommassa is de optelsom van het aantal protonen en neutronen.
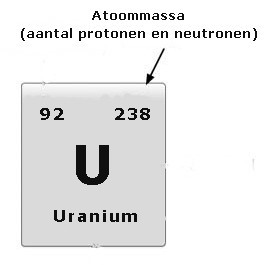
Het aantal neutronen in de kern kan binnen een element echter verschillen. De atoommassa varieert. Sommige atomen zijn zwaarder dan anderen. Zo bestaat er bijvoorbeeld uranium-238 en uranium-235, waarbij uranium-235 in de kern drie neutronen minder heeft.

Het aantal neutronen in de kern heeft geen invloed op de scheikundige eigenschappen van een element. Uranium-235 gedraagt zich bijvoorbeeld chemisch hetzelfde als uranium-238. Het aantal neutronen in de kern heeft wel invloed op natuurkundige (nucleaire) eigenschappen: als uranium-235 en uranium-238 bijvoorbeeld gebombardeerd worden met neutronen (splijting) gedragen ze zich anders.
Een atoomsoort met een specifiek aantal protonen en neutronen wordt een ‘nuclide’ genoemd. Zo’n specifieke atoomsoort is bijvoorbeeld uranium-235 of uranium-238. De schrijfwijze van een nuclide is meestal als volgt:
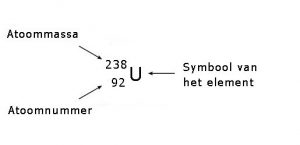
Isotopen zijn nucliden met een hetzelfde atoomnummer (van hetzelfde element), maar met een verschillend aantal neutronen. Men spreekt over de verschillende isotopen van een element.

Van de 23 bekende isotopen van uranium, komen bovenstaande drie voor in de natuur
De woorden ‘nuclide’ en ‘isotoop’ worden vaak verkeerd gebruikt, bijvoorbeeld als synoniem.
§2 KERNLADING EN INSTABILITEIT
De verschillende deeltjes in het atoom hebben een verschillende elektrische lading. De lading van een proton is gelijk gesteld aan +1, de lading van een elektron aan -1. Een neutron is elektrisch neutraal. Een atoom is neutraal als het evenveel protonen als elektronen bevat.

In een atoomkern stoten de positieve protonen elkaar af (‘elektrostatische kracht’), maar worden bij elkaar gehouden door de ‘sterke kernkracht’. Dit zijn twee van de ‘vier fundamentele natuurkrachten’. Voor dit samenlijmen van de kern hebben alle atomen (behalve waterstof) ook neutronen nodig.
In een stabiele atoomkern zijn de afstotende en aantrekkende krachten in evenwicht. De verhouding van protonen en neutronen is in zulke kernen precies goed.
Naarmate de atoomkern groter is raakt de verhouding tussen protonen en neutronen uit balans. Er zijn teveel deeltjes en er is teveel interne energie. De kern is hierdoor instabiel (radioactief). Elk element vanaf atoomnummer 82 heeft een instabiele kern, maar ook lichtere atomen kunnen een instabiele kern hebben.

Van nature heeft een kern echter de neiging om stabiel te willen worden door te vervallen.
